RELATED PRODUCTS NOT AVAILABLE
true


- Visión General
- Products & Accessories
- EIFU y Recursos
- FAQs
false
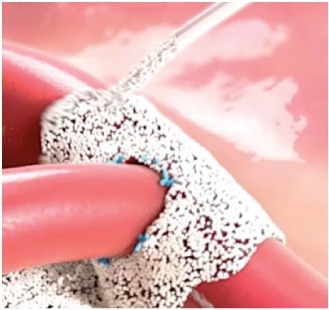
SENCILLO
- Sin necesidad de mezclar ni refrigerar
- Listo cuando se necesite y 5 años de vida útil
- Quite la tapa y aplique el polvo directamente en el punto de sangrado2
SEGURO
- Libre de trombina, biocompatible y apirógeno
- Es metabolizado por las enzimas amilasas y se absorbe normalmente en 24-48 horas*
* Debido a que se han notificado casos de disminución de la actividad de las amilasas en recién nacidos hasta 10 meses, las tasas de absorción de Arista™ AH en esta población pueden ser más de 48 horas.
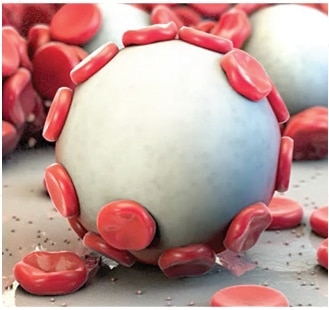
Tecnología MPH™ patentada: un enfoque único para lograr la hemostasia
El poder de Arista™ AH reside en su tecnología MPH™ (hemoesferas microporosas de polisacáridos) patentada. Compuestas por partículas microporosas con un tamaño de poro controlado, las esferas están diseñadas para actuar como un tamiz molecular. La potente acción osmótica deshidrata y gelifica la sangre en contacto para acelerar el proceso de coagulación natural.

EFICAZ
- El proceso de coagulación comienza al contacto, independientemente del estado de coagulación del paciente3
- La hemostasia completa se consigue en minutos1
- Proporciona una amplia área de cobertura en superficies rugosas y en áreas de difícil acceso
Video de animación del mecanismo de acción de Arista™ AH
Estudio clínico de Arista™ AH PMA P050038.
Consulte las Instrucciones de uso completas para obtener instrucciones detalladas sobre la aplicación.
Instrucciones de uso de Arista™ AH.
Descargos de responsabilidad
Es posible que no todos los productos, servicios, reclamos o características de los productos estén disponibles o sean válidos en su área local. Consulte con su representante local de BD.
Consulte en las etiquetas e instrucciones de uso de los productos las indicaciones, contraindicaciones, peligros, advertencias y precauciones.
Indicaciones
Arista™ AH está indicado en intervenciones quirúrgicas (excepto oftálmicas) como dispositivo hemostático complementario para ayudar cuando el control del sangrado capilar, venoso y arteriolar por presión, ligadura y otros procedimientos convencionales es ineficaz o poco práctico.
Contraindicaciones
No inyecte ni coloque Arista™ AH en los vasos sanguíneos, ya que puede existir posibilidad de embolización y muerte.
Advertencias
No se han evaluado clínicamente la seguridad y eficacia de Arista™ AH en niños, mujeres embarazadas o lactantes. Debido a que se han notificado casos de disminución de la actividad de las amilasas en recién nacidos hasta 10 meses, las tasas de absorción de Arista™ AH en esta población pueden ser más de 48 horas.
Una vez que se logra la hemostasia, el exceso de Arista™ AH debe eliminarse del lugar de aplicación mediante irrigación y aspiración, especialmente cuando se usa en los forámenes del hueso y a su alrededor, en áreas de confinación ósea, en la médula espinal o en el nervio y el quiasma óptico. Arista™ AH se hincha hasta su volumen máximo inmediatamente después del contacto con sangre u otros líquidos. El producto Arista™ AH seco y blanco debe eliminarse. La posibilidad de que el producto interfiera con la función normal o cause necrosis por compresión de los tejidos circundantes debido a la hinchazón se reduce al eliminar el exceso de material seco.
Este dispositivo se ha diseñado únicamente para un solo uso. La reutilización, la reesterilización, el reprocesamiento o el reenvasado podrían afectar a las características esenciales de los materiales y del diseño, que son fundamentales para el funcionamiento general del dispositivo y pueden provocar fallos en el dispositivo, lo que puede causar lesiones al paciente. La reutilización, el reprocesamiento, la reesterilización o el reenvasado también pueden crear un riesgo de contaminación del dispositivo o causar infección o infección cruzada en el paciente, entre otras, la transmisión de enfermedades infecciosas de un paciente a otro. La contaminación del dispositivo podría provocar lesiones, enfermedades o el fallecimiento del paciente o del usuario final.
Arista™ AH no está diseñado como sustituto de técnicas quirúrgicas meticulosas y la aplicación adecuada de ligaduras u otros procedimientos convencionales para la hemostasia.
No se han establecido la seguridad y eficacia en las intervenciones oftálmicas.
Arista™ AH no debe usarse para controlar el sangrado posparto o la menorragia.
Arista™ AH debe usarse con precaución en presencia de infección o en áreas contaminadas del cuerpo. Si aparecen signos de infección o absceso donde se ha aplicado Arista™ AH, puede ser necesario volver a operar para permitir el drenaje.
Deseche el dispositivo después de su uso. Este producto puede ser un riesgo biológico potencial. Manipule y elimine de acuerdo con la práctica médica aceptable y las leyes y reglamentos locales, estatales y federales aplicables.
Precauciones
Solo los médicos cualificados en las técnicas quirúrgicas apropiadas deben utilizar este dispositivo.
La seguridad y la eficacia para el uso en intervenciones neurológicas no se han establecido a través de estudios clínicos aleatorizados.
Cuando Arista™ AH se utilice junto con circuitos de recuperación de sangre autóloga, siga cuidadosamente las instrucciones de la sección Administración acerca de la filtración adecuada y el lavado celular.
Arista™ AH está diseñado para utilizarse en estado seco. El contacto con soluciones salinas o antibióticas antes de lograr la hemostasia dará lugar a la pérdida del potencial hemostático.
Arista™ AH se suministra como un producto estéril y no se puede volver a esterilizar. Los envases abiertos de Arista™ AH que no se utilicen deben desecharse.
No aplique más de 50 g de Arista™ AH en pacientes diabéticos, ya que se ha calculado que cantidades superiores a 50 g podrían afectar la carga de glucosa.
Arista™ AH no se recomienda para el tratamiento primario de los trastornos de la coagulación.
En intervenciones urológicas, Arista™ AH no debe dejarse en la pelvis renal o en los uréteres para eliminar los posibles focos de formación de cálculos.
No se ha realizado ninguna prueba sobre el uso de Arista™ AH en las superficies óseas a las que los materiales protésicos deben adherirse con adhesivos y, por lo tanto, no se recomienda.
Reacciones adversas
En un ensayo clínico aleatorizado, prospectivo y controlado simultáneamente, un total de 288 pacientes aleatorizados recibieron Arista™ AH o el control (esponja de gelatina con o sin trombina). Los acontecimientos adversos más frecuentes registrados fueron dolor relacionado con la cirugía, anemia, náuseas y valores de laboratorio fuera del rango normal. La siguiente es una lista completa de acontecimientos adversos notificados en más del 5 % de los pacientes tratados con Arista™ AH. Se mencionan los acontecimientos adversos correspondientes para el grupo de control para su comparación. Ninguno de los acontecimientos adversos que se produjeron se consideraron por el Comité de Supervisión de Datos y Seguridad como relacionados con el uso de Arista™ AH. Consulte en las etiquetas y los prospectos de los productos para obtener cualquier indicación, contraindicaciones, peligros, advertencias, precauciones e instrucciones de uso.
false
true
-

The BD Ambulatory Surgery Center portfolio of category-leading products, innovative solutions and dedicated support is designed to help ASCs improve clinical efficiency and enhance patient care.
-

BD hemostats come in various forms that all help accelerate natural clot formation in many surgical applications. They facilitate use with features such as preloaded applicators and ready-to-use designs.
-

BD sealants are designed to meet the needs of clinicians in thoracic and aortic surgery
-

We offer a full portfolio of surgical products
false
true
false
true
Estudio clínico de Arista™ AH PMA P050038.
Consulte las Instrucciones de uso completas para obtener instrucciones detalladas sobre la aplicación.
Instrucciones de uso de Arista™ AH.
Descargos de responsabilidad
Es posible que no todos los productos, servicios, reclamos o características de los productos estén disponibles o sean válidos en su área local. Consulte con su representante local de BD.
Consulte en las etiquetas e instrucciones de uso de los productos las indicaciones, contraindicaciones, peligros, advertencias y precauciones.
Indicaciones
Arista™ AH está indicado en intervenciones quirúrgicas (excepto oftálmicas) como dispositivo hemostático complementario para ayudar cuando el control del sangrado capilar, venoso y arteriolar por presión, ligadura y otros procedimientos convencionales es ineficaz o poco práctico.
Contraindicaciones
No inyecte ni coloque Arista™ AH en los vasos sanguíneos, ya que puede existir posibilidad de embolización y muerte.
Advertencias
No se han evaluado clínicamente la seguridad y eficacia de Arista™ AH en niños, mujeres embarazadas o lactantes. Debido a que se han notificado casos de disminución de la actividad de las amilasas en recién nacidos hasta 10 meses, las tasas de absorción de Arista™ AH en esta población pueden ser más de 48 horas.
Una vez que se logra la hemostasia, el exceso de Arista™ AH debe eliminarse del lugar de aplicación mediante irrigación y aspiración, especialmente cuando se usa en los forámenes del hueso y a su alrededor, en áreas de confinación ósea, en la médula espinal o en el nervio y el quiasma óptico. Arista™ AH se hincha hasta su volumen máximo inmediatamente después del contacto con sangre u otros líquidos. El producto Arista™ AH seco y blanco debe eliminarse. La posibilidad de que el producto interfiera con la función normal o cause necrosis por compresión de los tejidos circundantes debido a la hinchazón se reduce al eliminar el exceso de material seco.
Este dispositivo se ha diseñado únicamente para un solo uso. La reutilización, la reesterilización, el reprocesamiento o el reenvasado podrían afectar a las características esenciales de los materiales y del diseño, que son fundamentales para el funcionamiento general del dispositivo y pueden provocar fallos en el dispositivo, lo que puede causar lesiones al paciente. La reutilización, el reprocesamiento, la reesterilización o el reenvasado también pueden crear un riesgo de contaminación del dispositivo o causar infección o infección cruzada en el paciente, entre otras, la transmisión de enfermedades infecciosas de un paciente a otro. La contaminación del dispositivo podría provocar lesiones, enfermedades o el fallecimiento del paciente o del usuario final.
Arista™ AH no está diseñado como sustituto de técnicas quirúrgicas meticulosas y la aplicación adecuada de ligaduras u otros procedimientos convencionales para la hemostasia.
No se han establecido la seguridad y eficacia en las intervenciones oftálmicas.
Arista™ AH no debe usarse para controlar el sangrado posparto o la menorragia.
Arista™ AH debe usarse con precaución en presencia de infección o en áreas contaminadas del cuerpo. Si aparecen signos de infección o absceso donde se ha aplicado Arista™ AH, puede ser necesario volver a operar para permitir el drenaje.
Deseche el dispositivo después de su uso. Este producto puede ser un riesgo biológico potencial. Manipule y elimine de acuerdo con la práctica médica aceptable y las leyes y reglamentos locales, estatales y federales aplicables.
Precauciones
Solo los médicos cualificados en las técnicas quirúrgicas apropiadas deben utilizar este dispositivo.
La seguridad y la eficacia para el uso en intervenciones neurológicas no se han establecido a través de estudios clínicos aleatorizados.
Cuando Arista™ AH se utilice junto con circuitos de recuperación de sangre autóloga, siga cuidadosamente las instrucciones de la sección Administración acerca de la filtración adecuada y el lavado celular.
Arista™ AH está diseñado para utilizarse en estado seco. El contacto con soluciones salinas o antibióticas antes de lograr la hemostasia dará lugar a la pérdida del potencial hemostático.
Arista™ AH se suministra como un producto estéril y no se puede volver a esterilizar. Los envases abiertos de Arista™ AH que no se utilicen deben desecharse.
No aplique más de 50 g de Arista™ AH en pacientes diabéticos, ya que se ha calculado que cantidades superiores a 50 g podrían afectar la carga de glucosa.
Arista™ AH no se recomienda para el tratamiento primario de los trastornos de la coagulación.
En intervenciones urológicas, Arista™ AH no debe dejarse en la pelvis renal o en los uréteres para eliminar los posibles focos de formación de cálculos.
No se ha realizado ninguna prueba sobre el uso de Arista™ AH en las superficies óseas a las que los materiales protésicos deben adherirse con adhesivos y, por lo tanto, no se recomienda.
Reacciones adversas
En un ensayo clínico aleatorizado, prospectivo y controlado simultáneamente, un total de 288 pacientes aleatorizados recibieron Arista™ AH o el control (esponja de gelatina con o sin trombina). Los acontecimientos adversos más frecuentes registrados fueron dolor relacionado con la cirugía, anemia, náuseas y valores de laboratorio fuera del rango normal. La siguiente es una lista completa de acontecimientos adversos notificados en más del 5 % de los pacientes tratados con Arista™ AH. Se mencionan los acontecimientos adversos correspondientes para el grupo de control para su comparación. Ninguno de los acontecimientos adversos que se produjeron se consideraron por el Comité de Supervisión de Datos y Seguridad como relacionados con el uso de Arista™ AH. Consulte en las etiquetas y los prospectos de los productos para obtener cualquier indicación, contraindicaciones, peligros, advertencias, precauciones e instrucciones de uso.
false
true
false
true